Historique
Sources d’émission
Processus
Conséquences
Références
Historique
Les pluies acides constatées en Europe dans les années 70 et 80 sont principalement dues à l’augmentation des émissions de soufre et d’azote (SOx, NOx et NHx) dans l’atmosphère, provenant des rejets industriels, automobiles et agricoles. Ces différents polluants peuvent être transportés sur de très longues distances par les courants aériens, traverser les frontières et se déposer sur des écosystèmes éloignés de la source d’émission. En Europe, les dépôts de soufre et d’azote ont été maximaux dans les années 80-90, ceux de soufre touchant particulièrement l’Europe du nord et l’Europe centrale tandis que ceux d’azote ont touché toute l’Europe (Figure 1 à gauche). Bien que ces dépôts tendent à diminuer aujourd’hui, ils restent encore très importants en Europe de l’est pour le soufre, et sur toute l’Europe pour l’azote (Figure 1 à droite). En France, ces dépôts ont été maximaux dans le massif Vosgien, qui a été et est encore la région la plus impactée par l’acidification en France.
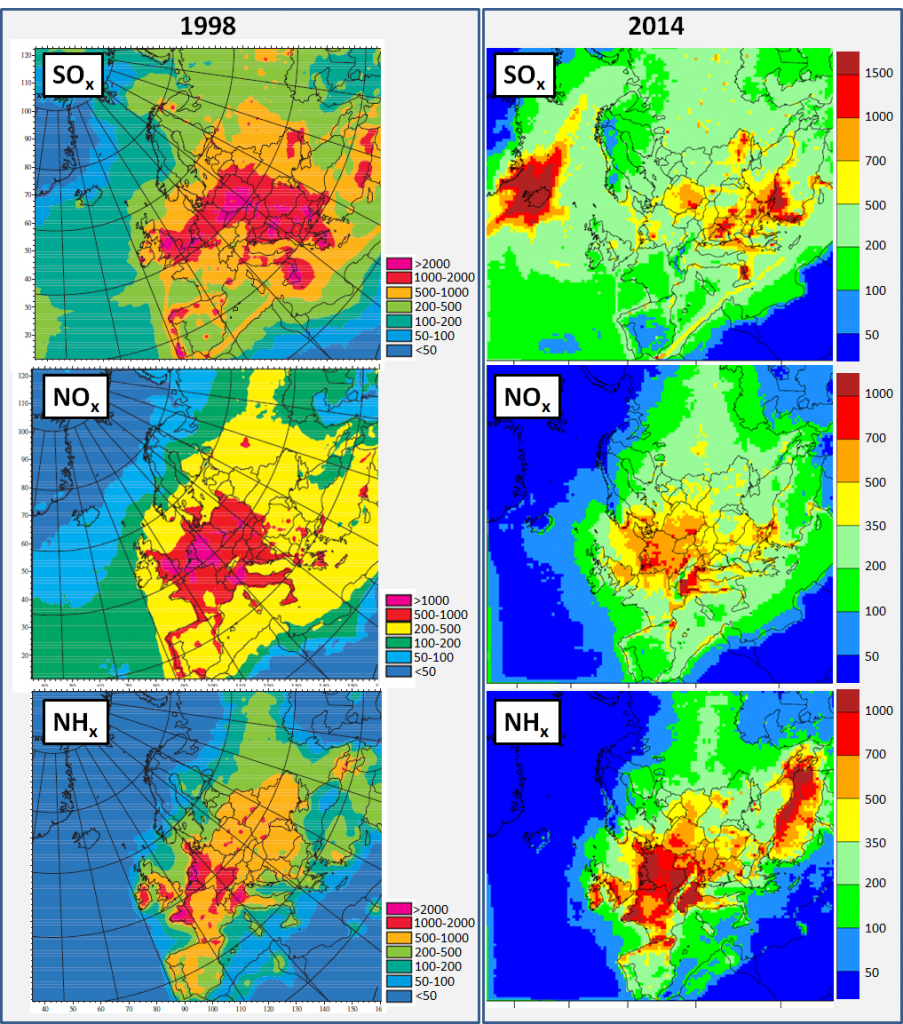
De nos jours, les émissions de soufre en France métropolitaine ont été réduites de 95% (CITEPA/format SECTEN – Avril 2018) et celles d’azote oxydé (NOx) d’environ 60%, grâce aux mesures prises notamment dans le cadre de la Convention sur la pollution atmosphérique transfrontalière à longue distance (CLRTAP). Les dépôts d’azote réduit restent significatifs. Les émissions d’ammoniac (NH3) sont quant à elles en très faible diminution (Figure 2), ses sources principales (notamment l’agriculture) ne diminuant pas. Les scientifiques prévoient une diminution des dépôts de soufre qui se prolonge pour la période 2020-2040 sur le territoire français. Par contre, les prédictions des dépôts d’oxyde d’azote sont plus contrastées : ils diminueraient sur la façade Ouest et dans le Nord-Est, mais augmenteraient sur la façade Est et dans le Nord-Ouest, et resteraient relativement stables sur la partie centrale du territoire (Pascaud et al., 2016).

Sources d’émission
Les émissions anthropiques (d’origine humaine)
Les 6 principales sources d’émission de SO2 (>5 % du total des émissions) sont (CITEPA, 2015) :
- raffinage de pétrole (20 %)
- métallurgie des métaux ferreux (12%)
- minéraux non métalliques et matériaux de construction (11%)
- chimie (10 %)
- production d’électricité (9,6 %)
- résidentiel (9,5 %)
- tertiaire (7,7 %)
Les 4 principales sources d’émission de NOx (> 5 % du total des émissions) sont (CITEPA, 2015) :
- voitures particulières diesel (24%)
- poids lourds diesel (y compris bus et cars) (18 %)
- autres sources de l’agriculture (installations de combustion et engins mobiles non routiers) (7,9 %)
- résidentiel (12 %) ;
Les 2 principales sources d’émission de NHx sont (CITEPA, 2015) :
- élevage (64%)
- culture (34%) dont :
- culture avec engrais (34%)
- épandage des boues (0,2%)
- écobuage (0,2%)
Les émissions non-anthropiques (dites naturelles)
Les émissions naturelles de SO2, NOx et NHx sont issues de processus biogéniques, marins, terrigènes, volcaniques et dus à la foudre.
Dans les écosystèmes terrestres, et notamment dans les sols, les processus microbiens engendrent des émissions d’azote (NO, N2 et N2O) et de soufre (NOx).
Dans les écosystèmes aquatiques, comme les cours d’eau et les océans, il y a également émission de soufre et d’azote, principalement sous forme de diméthylsulfure ((CH3)2S) et d’ammoniac (NH3).
Des gaz soufrés et azotés peuvent également être produits lors d’éruptions volcaniques (soufre) ou d’activité électrique dues aux orages (azote).
Processus
Les SO2 et NOx émis dans l’atmosphère subissent différentes réactions chimiques qui les transforment en sulfates et en nitrates, ou en acide sulfurique et en acide nitrique selon les conditions. Ces composés retombent sous forme de dépôts ou pluies acides sur les écosystèmes, pouvant provoquer une acidification des milieux. L’acidification se traduit dans le sol par une augmentation de protons (H+) et d’aluminium (Al3+) en solution, et par le lessivage des éléments cations nutritifs (Calcium, Ca ; Magnésium, Mg ; Potassium, K). Ainsi, les concentrations en cations basiques diminuent dans le sol, et l’aluminium, à forte concentration, dans des conditions de pH faible, devient toxique. À partir d’une certaine concentration en protons et aluminium en solution (limite critique), et de proportion entre nutriments et aluminium disponibles, les effets de l’acidification commencent à apparaître sur les arbres et plus généralement sur l’équilibre de l’écosystème.
Les dépôts d’azote modifient les cycles biogéochimiques des écosystèmes aquatiques et terrestres, en augmentant les quantités d’azote disponibles pour les organismes. Or l’azote est l’un des principaux éléments limitants, avec le phosphore, de la croissance des organismes en milieu naturel. Cet apport d’azote peut provoquer un déséquilibre en éléments nutritifs pouvant entraîner des carences chez certaines espèces, ou au contraire favoriser le développement d’autres, phénomène pouvant être amplifié par l’apport conjoint du phosphore par les activités agricoles. Les espèces nitrophiles vont alors se développer et supplanter les espèces en place dans le milieu, affectant la biodiversité.
Conséquences
Sur les écosystèmes terrestres
L’acidification du sol et des eaux de ruissellement peut conduire à des carences en éléments nutritifs pour les espèces végétales, affectant la biodiversité. En forêt, les espèces végétales sont d’autant plus sensibles à d’autres perturbations qu’elles sont carencées, et l’acidification et les sécheresses peuvent conduire à un jaunissement des arbres et un dépérissement. Dans les pays nordiques ou d’Europe centrale, ce phénomène a touché une vaste superficie de forêt dans les années 80. En France, ce sont principalement les forêts du Nord-Est (Vosges, Ardennes) qui ont souffert de l’acidification des sols jusqu’à présent (voir travaux du Point Focal National).

En modifiant les équilibres en éléments nutritifs du sol, les dépôts d’azote perturbent les écosystèmes terrestres et entraînent une baisse de la biodiversité en espèce végétale (Figure 3), de l’ordre de 23% de perte pour 17 Kg d’azote déposé par hectare et par an, soit le dépôt moyen européen (d’après Stevens et al. 2004). L’azote étant un élément limitant la croissance des espèces végétales, ces dépôts favorisent la croissance d’espèces nitrophiles (qui aiment l’azote), qui supplantent les espèces supportant moins bien les milieux riches en azote, modifiant les communautés végétales. De plus, l’apport d’azote peut favoriser la croissance des arbres en forêt. Cependant, une croissance accrue des arbres implique un besoin en éléments nutritifs accrus. Si les autres éléments nutritifs viennent à manquer, le déséquilibre produit peut affecter la croissance des arbres et finalement entraîner leur dépérissement.

Sur les écosystèmes aquatiques
L’acidification de l’eau et du compartiment sol affecte directement la faune et la flore des milieux. Dans le cas des eaux de surface, comme par exemple les lacs, l’acidification entraîne une diminution de l’alcalinité. Elle dépend du pouvoir tampon des sols et des roches drainées. Dans le Vosges, les sources drainant des grès se sont acidifiées sous l’effet des retombées atmosphériques acides pendant 40 ans, mais l’acidification a été plus ou moins importante et retardée selon la capacité des roches à neutraliser les acides (Probst et al., 1999).
Elle a un effet direct sur le pH de l’eau et peut entraîner des dommages sur les organismes vivants aquatiques dans un délai relativement court. Les animaux à coquilles peuvent subir des dommages ou rencontrer des difficultés à la constituer. Par réaction en chaîne, les prédateurs de ces organismes à coquille peuvent manquer de nourriture si ces organismes à coquilles disparaissent.

En France, des études portant sur les populations de truites des ruisseaux Vosgiens ont également montré l’existence d’un lien entre le pH, l’alcalinité et le nombre de truites présentes (Figure 5). Lorsque le pH atteint un certain seuil (ph=5,5, valeur proche de la neutralité en présence de CO2 atmosphérique), l’aluminium passe en solution et à une concentration de 200 µg.l-1, les truites ne sont plus présentes dans les ruisseaux (Probst et al., 1990). En parallèle, Guérold et al. (2000) ont montré que la diversité taxonomique des invertébrés diminuait avec l’augmentation de l’acidité des cours d’eau vosgiens.

Dans les lacs et cours d’eau à faible débit, l’apport d’azote peut aussi induire une prolifération d’algues dû à l’augmentation de cet élément nutritif (eutrophisation), et peut ainsi conduire à une fermeture du milieu et à une anoxie (manque d’oxygène), impactant directement la flore et la faune.
Sur les populations humaines
L’acidité des eaux de sources peut également entraîner des risques sanitaires. Dans les années 80, de nombreux cas de saturnisme ont été détectés dans le massif vosgien. Cette maladie est due à une ingestion répétée de plomb et peut provoquer entre autres des douleurs abdominales, des céphalées, un retard mental…. Une partie des habitations recevaient directement de l’eau de source au travers de canalisations en plomb. Chez certains habitants (eau du robinet), les concentrations en plomb dans l’eau étaient cent fois supérieures à la limite de potabilité ! En effet, plus l’eau acide des sources stagnait dans les canalisations une partie de la journée ou de la nuit, plus sa concentration en plomb augmentait (Dambrine et al. 1999).
L’eutrophisation des régions côtières peut entraîner un bloom d’algues vertes sur les plages, dont la décomposition peut émettre des gaz toxiques et mettre en danger la vie des hommes et des animaux.
Sur les bâtiments
Les pluies acides endommagent également les bâtiments construits, notamment en pierres calcaires, ainsi que que les éléments de nature métallique (plomb qui lient les vitraux par exemple). Pour plus d’informations, vous pouvez consulter le site du Programme International Concerté (PIC) Matériaux.
Références
- CITEPA, 2015 – Format SECTEN
- CITEPA, avril 2018 – Format SECTEN
- DAMBRINE E., PARTY J.-P., POLLIER B., NICOLAÏ M., PROBST A., ROZIN C., and DUC M. (1999). Acidification des eaux de sources et saturnisme dans le massif vosgien. Revue Forestière Française, 51 (2) : 173-183.
- FAGERLI S., TSYRO S, DENBY B.R., OLIVIÉ D., NYÍRI A., GAUSS M., SIMPSON D., WIND P., BENEDICTOW A., MORTIER A., JONSON J.E., SCHULTZ M., KIRKEVÅG A., VALDEBENITO A., IVERSEN T., SELAND Ø., AAS W., HJELLBREKKE A.-G., SOLBERG S., RUD R.O., TØRSETH K., YTTRI K.E., BRENDLE C., MARECKOVA M., PINTERITS M., SCHINDLBACHER S., TISTA M., ULLRICH B., WANKMÜLLER R., POSCH M., MONA L., NAVARRO J.-C.A., EKMAN A., HANSSON H.-C., RIIPINEN I., STRUTHERS H., and VARMA V. (2016). Transboundary Particulate Matter, Photo-oxydants, Acidifying and Eutrophying Components. EMEP Report 1/2016. Norwegian Meteorological Institute, Oslo.
- GUÉROLD F., BOUDOT J.-P., JACQUEMIN G., VEIN D., MERLET D., and ROUILLER J. (2000). Macroinvertebrate community loss as a result of headwater stream acidification in the Vosges Mountains (N-E France). Biodiversity and Conservation, 9: 767-783.
- Inventaire forestier département du Haut-Rhin (1999). IIIème inventaire.
- PASCAUD A., SAUVAGE S., PAGÉ C., ROUSTANT O., PROBST A., NICOLAS M., CROISÉ L., MEZDOUR A., et CODDEVILLE P. (2016). Composition chimique des dépôts atmosphériques à l’horizon 2020-2040. La Météorologie, 56-65.
- PROBST A., MASSABIAU J.-C., PROBST J.-L., and FRITZ B. (1990). Acidification des eaux de surface sous l’influence des précipitations acides : rôle de la végétation et du substratum, conséquences pour les populations de truites. Le cas des ruisseaux des Vosges. C. R. Acad. Sci. Paris, t. 311, Série II, 405-411.
- PROBST A., PARTY J.-P., FÉVRIER C., DAMBRINE E., THOMAS A.L., STUSSI J.M. (1999). Evidence of springwater acidification in the Vosges mountains (North-East of France) : influence of bedrock buffering capacity. Water, Air and Soil Pollution, 114 (3-4): 395-411.
- STEVENS C.J., DISE N.B., MOUNTFORD J.O., and GOWING D.J. (2004). Impact of Nitrogen Deposition on the Species Richness of Grasslands. Science, 303(5665): 1876-1879.
- TARRASON L., and SCHAUG J. (2000). Transboundary acidification and eutrophication in Europe. EMEP summary report 2000, EMEP/MSC-W 1/2000. Norwegian Meteorological Institute, Oslo.